2024 نویسنده: Howard Calhoun | [email protected]. آخرین اصلاح شده: 2023-12-17 10:25
تجزیه الکتریکی نقش بسیار زیادی در زندگی ما ایفا می کند، اگرچه ما معمولاً به آن فکر نمی کنیم. با این پدیده است که هدایت الکتریکی نمک ها، اسیدها و بازها در یک محیط مایع مرتبط است. از اولین ضربانهای قلب ناشی از الکتریسیته زنده در بدن انسان، که هشتاد درصد آن مایع است، گرفته تا ماشینها، تلفنهای همراه و بازیکنان، که باتریهای آنها اساساً باتریهای الکتروشیمیایی هستند، تفکیک الکتریکی بهطور نامرئی در همه جای ما وجود دارد.

در کاسه های غول پیکری که بخارات سمی از بوکسیت ذوب شده در دمای بالا منتشر می کنند، فلز "بالدار" - آلومینیوم از طریق الکترولیز به دست می آید. همه چیز در اطراف ما، از توری رادیاتور کرومی گرفته تا گوشوارههای نقرهکاری شده در گوشهایمان، یک باریا مواجهه با محلول ها یا نمک های مذاب و از این رو با این پدیده. بیهوده نیست که تفکیک الکتریکی توسط یک شاخه کامل علم - الکتروشیمی مطالعه می شود.
وقتی حل می شود، مولکول های مایع حلال با مولکول های ماده محلول وارد پیوند شیمیایی می شوند و حلولات تشکیل می دهند. در محلول های آبی، نمک ها، اسیدها و بازها بیشترین حساسیت را به تجزیه دارند. در نتیجه این فرآیند، مولکول های املاح می توانند به یون تجزیه شوند. به عنوان مثال، تحت تأثیر یک حلال آبی، یون های Na+ و CI- در بلور یونی NaCl به محیط حلال عبور می کنند. کیفیت جدید ذرات حل شده (هیدراته).

این پدیده که اساساً فرآیند تجزیه کامل یا جزئی یک ماده محلول به یون در نتیجه عمل یک حلال است، "تجزیه الکتریکی" نامیده می شود. این فرآیند برای الکتروشیمی بسیار مهم است. این واقعیت بسیار مهم است که تفکیک سیستم های چند جزئی پیچیده با یک جریان گام به گام مشخص می شود. با این پدیده، تعداد یونهای موجود در محلول نیز افزایش مییابد که مواد الکترولیتی را از غیر الکترولیتی متمایز میکند.
در فرآیند الکترولیز، یونها جهت حرکت واضحی دارند: ذرات با بار مثبت (کاتیونها) - به یک الکترود با بار منفی به نام کاتد، و یونهای مثبت (آنیونها) - به آند، الکترود با بار مخالف، جایی که آنها تخلیه می شوند. کاتیون ها احیا می شوند و آنیون ها اکسید می شوند.بنابراین، تفکیک یک فرآیند برگشت پذیر است.

یکی از ویژگی های اساسی این فرآیند الکتروشیمیایی درجه تفکیک الکترولیتی است که به صورت نسبت تعداد ذرات هیدراته به تعداد کل مولکول های ماده محلول بیان می شود. هر چه این شاخص بالاتر باشد، الکترولیت این ماده قوی تر است. بر این اساس، تمام مواد به الکترولیت های ضعیف، متوسط و قوی تقسیم می شوند.
درجه تفکیک به عوامل زیر بستگی دارد: الف) ماهیت املاح. ب) ماهیت حلال، ثابت دی الکتریک و قطبیت آن؛ ج) غلظت محلول (هرچه این شاخص کمتر باشد، درجه تفکیک بیشتر است). د) دمای محیط انحلال. به عنوان مثال، تفکیک اسید استیک را می توان با فرمول زیر بیان کرد:
CH3COOH H+ + CH3COO-
الکترولیت های قوی تقریباً به طور غیرقابل برگشتی تجزیه می شوند، زیرا محلول آبی آنها حاوی مولکول های اصلی و یون های غیرهیدراته نیست. همچنین باید اضافه کرد که کلیه موادی که دارای پیوندهای شیمیایی قطبی یونی و کووالانسی هستند در معرض فرآیند تفکیک قرار می گیرند. نظریه تفکیک الکترولیتی توسط فیزیکدان و شیمیدان برجسته سوئدی اسوانته آرنیوس در سال 1887 فرموله شد.
توصیه شده:
تجزیه و تحلیل وضعیت: گزینه ها، ویژگی ها، مراحل و نتایج تجزیه و تحلیل
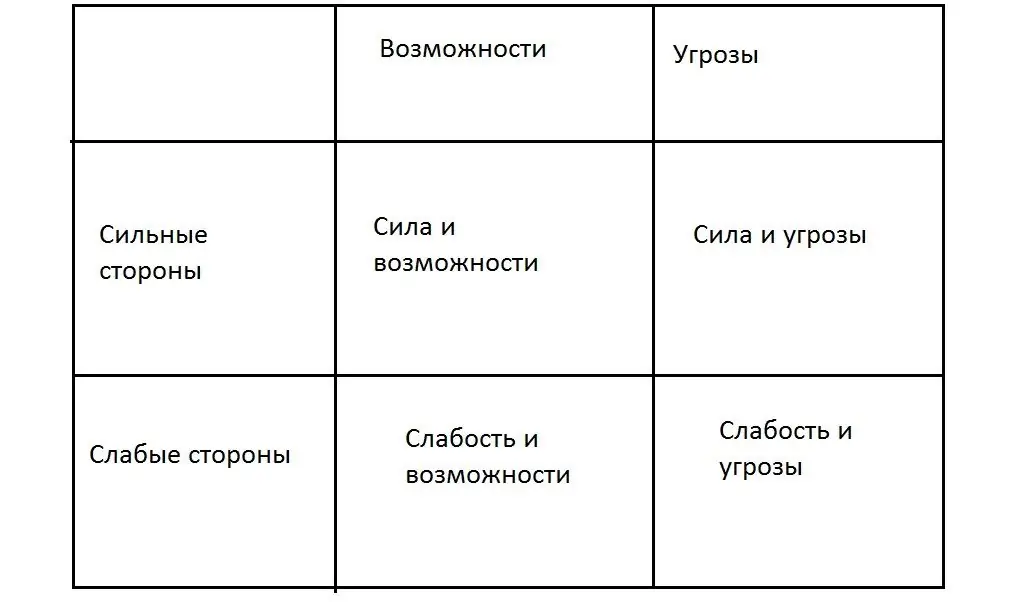
تحلیل موقعیت چیست؟ چه کسی و چه زمانی آن را انجام می دهد، مراحل اصلی تجزیه و تحلیل و ارزیابی وضعیت. روش ها و ابزارهای مورد استفاده در تحلیل موقعیت. چرا باید اجرا شود؟ اهمیت تجزیه و تحلیل وضعیت برای کار شرکت چیست؟
تجزیه و تحلیل سهام: روش های انجام، انتخاب روش های تجزیه و تحلیل، نکات و ترفندها

سهام چیست. چگونه سهام را تجزیه و تحلیل کنیم، از چه منابع اطلاعاتی برای این کار استفاده می شود. خطرات مرتبط با خرید سهام چیست؟ انواع تحلیل سهام، چه فرمول هایی استفاده می شود. ویژگی های تجزیه و تحلیل سهام شرکت های روسی، نکات و ترفندهایی برای جمع آوری اطلاعات و تجزیه و تحلیل سهام چیست؟
تجزیه - چیست؟ تجزیه اهداف. معنی کلمه "تجزیه"

برای انجام همه کارها، باید وظایف، اهداف را به درستی تنظیم کنید، اختیارات را توزیع و تفویض کنید. منطق و تحلیل بهترین کمک کننده در حل مسائل پیچیده هستند. یکی از ابزارهای ساخت منطقی تجزیه است. تجزیه به عنوان یک روش منطق عملی رسمی مستلزم مطالعه کیفی کار اصلی مطابق با هدف اصلی کار است. این رویکرد مشارکت پرسنل در تمام سطوح را برای حل وظایف چند سطحی تضمین می کند
تحلیل فعالیت های مالی و اقتصادی - مبانی نظری

گذار به روابط بازار مستلزم آن است که همه بنگاه ها بازده تولید را افزایش دهند که به نوبه خود باعث افزایش رقابت پذیری محصولات آنها می شود. مهمترین نقش در حل این مشکل را تجزیه و تحلیل فعالیت های مالی و اقتصادی ایفا می کند. با کمک این رشته علمی، برنامه های توسعه استراتژیک تدوین می شود، تصمیمات مدیریتی به صورت علمی اثبات می شود و اجرای آنها نظارت می شود
جریان الکتریکی چیست؟ شرایط وجود جریان الکتریکی: ویژگی ها و اقدامات

جریان الکتریکی یک بار الکتریکی در حال حرکت است. این می تواند به شکل تخلیه ناگهانی الکتریسیته ساکن مانند رعد و برق باشد. یا می تواند یک فرآیند کنترل شده در ژنراتورها، باتری ها، خورشیدی یا سلول های سوختی باشد. امروز ما مفهوم "جریان الکتریکی" و شرایط وجود جریان الکتریکی را در نظر خواهیم گرفت








